Trích:
Nguyên văn bởi m&m
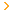
cho em hỏi cách giải bài này đúng ko ạ
cân khoảng 1,5g phức kali tris(oxalato)ferrat định mức thành 100ml, rút 10,00ml thêm 5ml dung dịc KI 20% đậy kín trong tối sau đó chuẩn độ bằng dd thiosulfat 0.1N, thể tích trung bình Na2S2O3 đã dùng là 1,30ml. Tính số mol Fe3+ trong phức
giải
2Fe3+ + 3I- = I3- + 2Fe2+
I3- + 2(S2O3)2- = (S4O6)2- + 3I-
N(Fe3+) =N(I3-)
=>N(Fe3+)*V(Fe3+)=N(thiosulfat)*V(thiosulfat)
=>(nFe3+/VFe3+) *(10/100)=0.1*1.3
=> nFe3+/0.01 =(0.1*1.3*100*0 .01)/10 =0.013 mol
em giải vậy có đúng không ạ, sao mấy bạn khác giải ra 0.0013mol, em không hiểu mấy tại sao các bạn lại chia thêm cho 10
|
Số mol đương lượng của Fe3+= số mol đương lượng của I3-
----> N(Fe3+)= 0.1*1.3*10^-3=1.3*10^-4 mol đương lượng
Số mol Fe3+ trong 100ml là:
(1.3*10^-4*100)/10 = 1.3*10^-3 mol