Trích:
Nguyên văn bởi trangiappro
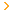
Độ tan của MgSO4 ở 20*C là 35,1g. Khi thêm 1g MgSO4 khan vào 100g dd MgSO4 bẵo hòa ở 20*C đã làm cho 1,58g MgSO4 (chất tan) tách ra ở dạng tinh thể ngậm nước. Tìm CT tinh thể ngậm nước.
|
Trước hết nhận thấy, bài này chẳng phải là bài tập Hoá phân tích => Bạn post nhầm BOX.
Cách giải:
Từ định nghĩa độ tan ở lớp 8, ta có:
Trong (100 + 35,1) gam dung dịch sẽ có 35,1 gam MgSO4
--------100 gam
----------------------> x = 25,98g
Thêm 1 gam MgSO4 khan thì có 1,58 gam MgSO4 (chất tan) bị kết tinh => Khối lượng MgSO4 còn lại trong dung dịch là: 25,98 + 1 - 1,58 =
25,4 gam
Ta có:
Trong (100 + 35,1) gam dung dịch sẽ có 35,1 gam MgSO4
----y = 97,765 gam
dung dịch <---------25,4 gam
Vậy khối lượng muối đã bị kết tinh sẽ là: 100 + 1 - 97,765 = 3,235 gam
=> Khối lượng H2O đã tham gia kết tinh là 3,235 - 1,58 =
1,655 gam
Từ đó dễ dàng xác định được công thức muối kết tinh là
MgSO4.7H2O