Hi everybody !
Cũng mấy ngày gòi ko vào diễn đàn thân iu, ko ngờ bao nhiêu topic hay, bổ ích được tạo ra và thảo luận sôi nổi ! Anh em ta mùa tết này khí thế quá ! Mình cũng phải hòa nhập mới được !
Bài đầu tiên trong kế họach viết chuỗi bài post dạng course mà mình muốn giới thiệu với anh em trong dịp Tết là về Radical reaction. Đây là mảng theo mình đánh giá khá thú vị, vì đơn giản rất ít tài liệu tham khảo chính qui về mảng này bằng tiếng Việt để hiểu sâu sắc bản chất của một tâm radical. Trước đây khá lâu cũng như gần đây có một số topic thảo luận về radical, radical mang điện tích gì, các vấn đề liên quan đến phản ứng của radical ... Đây là một mảng lớn của hóa học, trong bài này mình giới hạn chỉ bàn về
họat tính, cấu trúc & độ bền của radical dựa trên nền tảng lượng tử ứng dụng, đủ để giải quyết các khuất mắt mà các topic trứơc đây về radical đặt ra.
1. Giới thiệu: Nucleophilic và electrophilic radical.
Trước hết, cần khẳng định,
radical là một dạng tâm mềm (theo thuyết HSAB), đa số không có điện tích, và trong phản ứng hóa học thường nó tương tác với các phần tử không mang điện.
Nếu xét đến phương trình tổng quát định lượng họat tính hóa học của một hệ tương tác do Klopman và Salem đề xướng:

Trong trường hợp này, ta thấy Coulombic force có ảnh hưởng nhỏ trong khi frontier orbital interaction đóng góp lớn vào delta E khi xét tác nhân radical. Có thể chứng minh luận điểm tâm mềm của radical, khi ta xét sự tấn công của radical vào hệ liên hợp

,

-unsaturated carbonyl compound, thì sự tấn công của radical vào nối đôi carbon – carbon thuận lợi hơn nhóm carbonyl.
Một ví dụ cụ thể minh họa lập luận trên như sau, đó là phản ứng tổng hợp PMMA bằng radical polymerization.

Vấn đề thứ hai về
họat tính nucleophile và electrophile của radical. Phức tạp hơn các ion, orbital biên – orbital họat tính của radical là SOMO (singly occupied molecular orbital), sẽ tương tác được với cả HOMO hoặc LUMO của một phần tử khác, do đó, việc đánh giá tính chọn lọc cũng như họat tính của SOMO – radical tưong đối khó hơn so với ionic center. Quan sát sơ đồ sau:
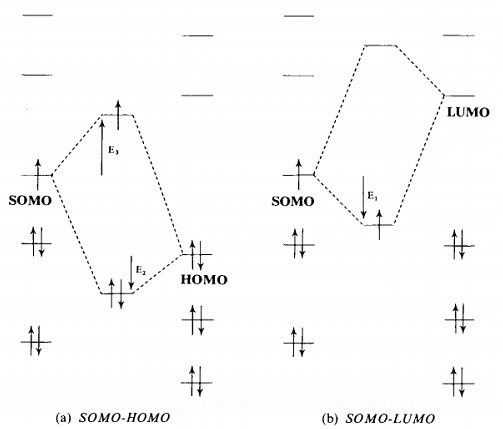
Việc tương tác với LUMO của hợp phần khác sẽ tạo tâm radical mới có năng lượng SOMO giảm xuống, trong khi điều này ngược lại khi tương tác với HOMO. Các tương tác trên đều tạo ra hệ thống mới bền hơn các hợp phần tương tác. Với tương tác SOMO-LUMO thì quá dễ dàng thấy rõ, còn với tương tác SOMO-HOMO thì ta thấy hai electron ở hạ năng, chỉ có một electron ở thượng năng, do đó năng lượng tổng cộng vẫn làm bền hệ.
Do bản chất tương tác của SOMO với hợp phần khác, tuân theo qui luật của term frontier (phương trình trên), do đó,
độ chênh lệch năng lượng của orbital hợp phần tương tác càng nhỏ thì tương tác càng thuận lợi, phản ứng xảy ra càng nhanh.
Như vậy, SOMO có năng lượng càng cao, đóng vai trò nucleophile, sẽ tương tác càng thuận lợi với LUMO có năng lượng thấp, và SOMO có năng lượng thấp, đóng vai trò là electrophile, sẽ tương tác thuận lợi với HOMO có năng lượng cao.

Đây là một luận điểm dễ hiểu, và tầm ứng dụng của nó khá rộng để giải thích đa số các trường hợp phản ứng đơn giản trong phản ứng thế gốc hydrocarbon.
Một ví dụ khá thú vị về luận điểm trên, đó là một phản ứng trong tổng hợp polymer.

Ta xuất phát điểm từ radical (380), radical centre này đính với nhóm carbonyl nên SOMO sẽ có năng lượng thấp, do đó sẽ tương tác nhanh chóng với vinyl acetate vốn có HOMO pi năng lượng cao (nhờ sự liên hợp p-pi của Oxygen). Radical mới hình thành bấy giờ SOMO mang năng lượng cao, vì đính với Oxygen gây hiệu ứng liên hợp, do đó sẽ dễ dàng phản ứng với double bond của fumarate vốn có LUMO năng lượng thấp (bởi sự hút electron liên hợp của nhóm carbonyl). Phản ứng tiếp diễn luân phiên hình thành lối phản ứng dạng alternative co-polymerization.
Ta đi vào sâu hơn về bản chất tương tác giữa orbital p của oxygen và radical centre trong ví dụ trên, tương tác này có thể nói giống với

-effect. Tuy nhiên trong

-effect thì sự tổ hợp là của nucleophilic centre với p-orbital (lone-pair).
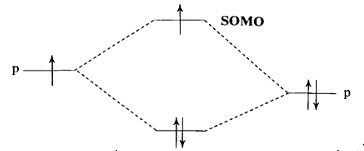
Sự tương tác này vẫn làm bền radical, mặc dù tạo ra SOMO mới có năng lượng cao hơn ban đầu, song như đã lập luận trên, hai electron ở hạ năng dư sức làm bền hệ thống. Điều này cũng giúp ta giải thích được độ bền của các radical sau:

Và radical (386) với (387) có thể cô lập chứng tỏ độ bền khá cao.
Một điểm lưu ý nữa trong lập luận giải thích phản ứng alternative polymerization trên, tránh những từ mơ hồ, ví dụ như “yếu tố phân cực” vốn được dùng rất nhiều trước đây. Ta nên dùng hẳn quan điểm tương tác của frontier orbital.

Tiếp theo là một ví dụ lớn mà có lẽ khá quen thuộc đối với các bạn Phổ Thông khối chuyên, khi tham khảo sách hữu cơ của ĐHSP Hà Nội. Phản ứng radical lấy hydrogen H* để tạo radical centre mới trên mạch. Chất nền ta xét ở đây là p-Y-toluene.

Trước hết, như ta đã biết radical attack vào C-H hay C-halogen bond, thì nó tương tác với orbital sigma bonding và orbital sigma antibonding. Mặc khác,

* có năng lượng cao (vì liên kết sigma theo quan điểm VB là sự xen phủ trục, nên đưa tới vùng tổ hợp lớn, liên kết bền, và

* có năng lượng cao.) do đó, có thể dự đóan tương tác chính của radical sẽ với orbital sigma bonding

. Như vậy radical thể hiện tính electrophile. Có thể nhìn thấy rõ bản chất electrophile của radical khi quan sát bảng số liệu sau:
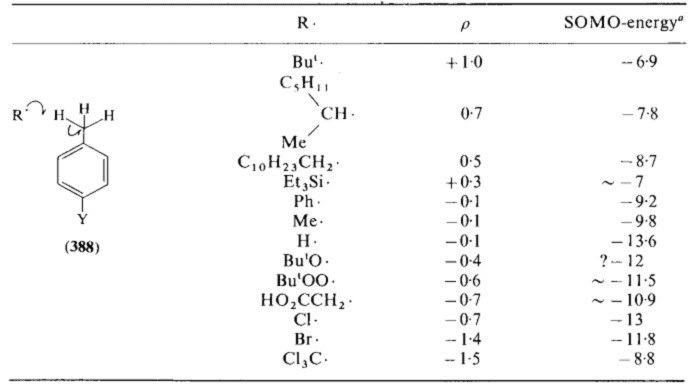
Hệ số rô trong phương trình Hammet đa số nhận giá trị âm, chứng tỏ nhóm thế Y cho điện tử thuận lợi. Tuy nhiên trị tuyệt đối hệ số này nhỏ, nên có thể kết luận ảnh hưởng (độ nhạy) của bản chất điện tử nhóm thể Y đến phản ứng ko lớn, điều đó chứng minh một lần nữa rằng bản chất sự tấn công của radical ít bị ảnh hưởng bởi coloumbic force.
Qua hệ số rô ta còn biết thêm, ứng với từng radical R*, giá trị tuyệt đối của rô càng lớn thì phản ứng xảy ra càng nhanh, hay tương tác càng thuận lợi. Các radical như triethylsilyl hay alkyl (t-butyl) có năng lượng SOMO cao, do đó phản ứng xảy ra chậm, tương tác ko thuận lợi, hay nói cách khác là tính electrophile kém. Trong khi các oxygen radical hay halogen radical có SOMO thấp, tính electrophile mạnh hơn.
Bảng số liệu trên còn giúp ta giải thích được hiệu ứng

-effect làm giảm họat tính của radical t-BuOO* 10000 lần so với t-BuO*. Đó là tòan bộ những nhận xét về mặt ảnh hưởng của cấu trúc radical.
Xét tiếp theo ảnh hưởng của cấu trúc chất nền mang hydrogen hay halogen. Radical sẽ tấn công vào chất nền theo thứ tự cấu trúc sau:
Allylic > tertiary center > secondary center > primary center. Bởi vì càng nhiều hiệu ứng siêu liên hợp trong cấu trúc chất nền, sự xen phủ giữa orbital pi của các nhóm +H(hyperconjugation) với orbital sigma bonding C-H, đây là tương tác giữa các orbital được điền đầy electron, gây ra sự tăng năng lượng của HOMO, và sẽ tương tác dễ hơn với radical.
Một ví dụ R* tấn công bứt halogen của chất nền hal-R’, ta dễ dàng nhận xét thứ tự họat tính của chất nền là I > Br > Cl, vì đơn giản năng lượng của HOMO của sigma bond giảm theo thứ tự trên.
Một ví dụ khác, so sánh sự khác nhau về vị trí tấn công của hai tác nhân Cl* và Me* vào propionic acid.
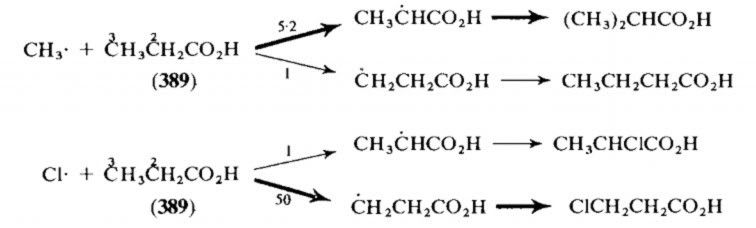
Ta thấy methyl radical tấn công hydrogen ưu thế ở carbon vị trí số 2, trong khi Cl* tấn công hydrogen ưu thế ở carbon vị trí số 3. Điều này có thể giải thích rất dễ dàng dựa trên luận điểm của frontier orbital, C-H của C2 liên hợp với carbonyl – một nhóm rút điện tử liên hợp, do đó HOMO và LUMO của sigma C-H có năng lượng thấp. Trong khi C-H của C3 siêu liên hợp với –CH2COOH là một nhóm nhả điển tử yếu (siêu liên hợp với orbital pi nhóm -CH2), và do đó năng lượng của HOMO và LUMO sigma C-H tăng lên một chút. Mặt khác, bản chất tác nhân radical, SOMO của methyl có năng lượng cao hơn SOMO của Cl*,

Do vậy, methyl radical sẽ tương tác thuận lợi hơn với Hydrogen ở C2, và Cl* sẽ tương tác thuận lợi hơn với Hydrogen ở C3.
Còn tiếp, những phần sau cũng rất hấp dẫn !
.gif)
Bây giờ lướt các topic thôi !
Chúc anh em có một cái Tết ấm cúng, chúc các anh chị ở nước ngoài mùa Tết an lành !



