Phương pháp dùng muối hạ nhiệt độ của nước đá xuống dưới 0°C đã được áp dụng nhiều trong phòng thí nghiệm. Vậy bạn có biết tại sao các tinh thể muối làm được điều đó ?

Một viên muối đang làm tan tuyết ở xung quanh nó
Cho vài cục đá lạnh vào cái ly. Rắc muối lên rồi đặt nhiệt kế vào ly. Sau vài phút, thấy một phần đá trong ly tan thành nước và nhiệt kế hiển thị -1°C, -5°C, rồi -10°C …
T
ại sao nước đá có thể đạt đến nhiệt độ âm trong môi trường khí quyển bình thường ?
Trong điều kiện nhiệt độ, áp suất khí quyển, nhiệt nóng chảy của nước đá (hay còn gọi nhiệt đông đặc của nước) là 0oC. Trong cùng điều kiện đó nhưng có thêm muối, nhiệt đông đặc của nước có thể giảm xuống dưới 0oC. Khi đó, càng nhiều đá bị tan thành nước thì nhiệt độ càng hạ thấp cho đến khi đá tan hoàn toàn.
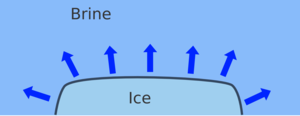
Khi thêm nước muối (brine) vào đá (ice). Nhiệt đông đặc của đá giảm và đá sẽ tan
Đá tan vì liên kết giữa các phân tử nước bị phá vỡ, do đó quá trình đòi hỏi một lượng nhiệt lớn từ môi trường xung quanh: tức là hỗn hợp nước đá-muối sẽ càng lạnh hơn khi đá càng tan, và dừng lại khi đá tan hoàn toàn hay lúc hỗn hợp đạt đến điểm đông đặc của nước muối. Điểm đông của dung dịch muối NaCl là −21°C (252,15 K, −6°F), của dung dịch muối CaCl2 là -40°C (233,15 K, -40°F).
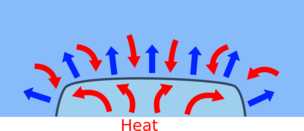
Quá trình hạ nhiệt độ đông đặc của nước đá cần nhiều nhiệt từ môi trường xung quanh cho đến khi đá tan hoặc hỗn hợp đạt đến nhiệt độ đông đặc của nước muối
Chính vì tính chất này mà hỗn hợp nước đá có muối được ứng dụng trong kỹ thuật làm tan băng trên đường phố, ở sân bay …
Vì sao đá tan khi thêm muối vào?
Ngay tại bề mặt tiếp xúc giữa đá và nước, thường xuyên xảy ra hai quá trình đối lập: quá trình đá tan chảy và quá trình nước bị đông đặc lại. Ngay cả khi hệ đạt đến trạng thái cân bằng (khi mà nước hoàn toàn đông đặc thành đá hoặc đá hoàn toàn tan chảy thành nước) thì hai quá trình này vẫn xảy ra, nhưng ở mức độ cân bằng. Nếu chúng ta hạ nhiệt độ xuống thì quá trình tan chảy giảm, do đó mà điểm đông đặc cũng giảm và quá trình đông đặc xảy ra mạnh mẽ hơn, tạo ra nhiều đá hơn là nước lỏng. Nếu chúng ta tăng nhiệt độ, quá trình ngược lại sẽ xảy ra.

Tại 0oC, số lượng phân tử nước tách ra và liên kết trở lại bề mặt đá là bằng nhau.
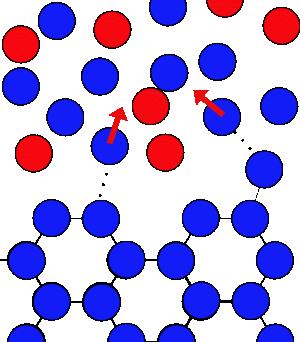
Khi muối (phân tử màu đỏ) được thêm vào, số lượng phân tử nước quay lại để tạo đá ít hơn lượng phân tử nước tách ra.
Nếu chúng ta cho muối (hoặc bất kỳ chất nào có thể hòa tan) vào nước, các phân tử nước sẽ bị giữ lại giữa phân tử muối và phải tốn thời gian nhiều hơn để chúng có thể quay trở lại tạo đá, do đó quá trình đông đặc sẽ chậm, quá trình tan chảy thì không thay đổi. Ở nhiệt độ thấp hơn, quá trình đông đặc xảy ra mạnh mẽ hơn, làm hạ nhiệt độ đông đặc dưới 0°C. Trong thực tế, nhiệt độ mà hỗn hợp nước đá và muối có thể đạt được là -180°C



